三特异性抗体为抗癌免疫治疗提供了第三种方法
Release Time:2019-11-20 对一个靶标具有特异性的抗体(称为单克隆抗体)是首个获得广泛临床应用的癌症免疫疗法。 可以通过改造抗体以识别两个不同的分子靶标(称为抗原)来增强抗体的治疗效力。 这些双特异性抗体可以同时与癌细胞和称为T细胞的免疫细胞结合,这种双重结合使T细胞释放出对癌细胞的杀伤力。 吴等人在《自然癌症》(Nature Cancer)一书中报道了一种三特异性抗体的开发,该抗体具有三个靶标:癌细胞,激活T细胞的受体和促进持久T细胞的T细胞蛋白。
哺乳动物的免疫系统产生大量的抗体,抗体也可以被工程化以识别治疗靶标。抗体通常识别单个抗原,该抗原可能是引起疾病的成分或蛋白质或糖的异常形式。这类针对癌细胞靶标的单特异性抗体可以募集免疫细胞,包括嗜中性粒细胞,天然杀伤细胞和巨噬细胞,以杀死或摄入癌细胞。
也可以对抗体进行改造,以阻断或刺激与其结合的蛋白质的功能。例如,存在抑制T细胞功能的调节受体,而经过工程设计以阻断这些受体的抗体提供了称为检查点阻断的临床策略,可增强T细胞功能。这些抑制性受体控制着T细胞衰竭,T细胞衰竭是一种无功能的T细胞状态,可以防止自身免疫,并且可以在肿瘤微环境中发生,因为癌症逃避了T细胞介导的抗肿瘤反应。检查点阻断疗法可以唤醒疲惫的抗肿瘤T细胞,从而获得巨大的临床益处,但同时也可能引起自身免疫毒性。 Wu及其同事开发的抗体采用类似的方法来增强针对癌细胞的T细胞活性。然而,他们的方法刺激了能积极增强T细胞功能的受体的功能,而不是阻断抑制性受体的功能。
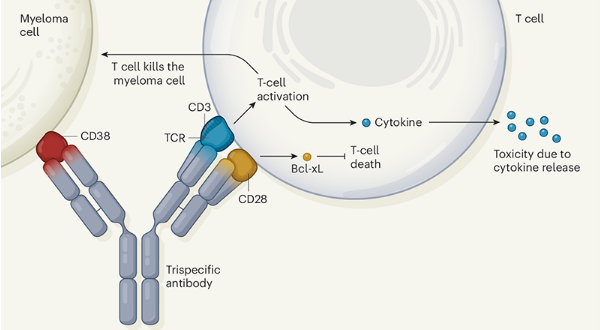
Wu等人开发的人抗体。 基于双特异性抗体技术,该技术可将两种不同抗体的抗原识别域重新配置为一个双特异性分子。 双特异性抗体通常将一种抗原靶向癌细胞表面,将一种抗原靶向T细胞上称为CD3的蛋白质复合物。 CD3是T细胞受体(TCR)复合物的一部分。 TCR还包括抗原识别结构域,并在抗原结合时向T细胞传递激活信号。 抗体与CD3的结合也会产生激活信号。 因此,这种双特异性抗体可以激活T细胞,使其与癌细胞紧密相连(与T细胞的天然抗原特异性无关),并将其杀伤能力重新导向癌细胞。
该概念已证明对靶向癌细胞上的CD3和CD19的双特异性抗体blinatumomab具有临床疗效。 Blinatumomab治疗可将晚期癌症B细胞急性淋巴细胞白血病(B-ALL)2的患者的缓解率和生存率提高一倍,并且正在作为B-ALL初始治疗的一部分进行测试,并有望在早期结果3。
Wu及其同事设计了一种聪明的策略,可同时促进T细胞活化并增强与多发性骨髓瘤有关的癌细胞的靶向性,多发性骨髓瘤是血液中浆细胞的癌症。作者开发了一种三特异性抗体,该抗体经工程改造,具有三个抗原结合位点,而不是两个。这种三特异性抗体靶向CD3以及蛋白质CD38(在癌细胞上)和CD28(在T细胞上)。靶向CD38的抗体daratumumab在临床上可有效治疗该疾病4,而CD38也是其他癌症(例如急性淋巴白血病和急性髓性白血病)的潜在靶标。
CD28属于一类蛋白,称为共刺激受体,可正向调节T细胞活化。当T细胞通过TCR识别其靶抗原时,共刺激受体(如CD28)需要额外参与才能实现有效免疫应答所需的持续T细胞增殖。在没有共同刺激的情况下,通过TCR激活会导致T细胞无反应状态(称为无反应状态)或相关的疲劳状态。在没有共同刺激的情况下,长时间激活TCR可能导致T细胞经历一种称为细胞凋亡的程序性细胞死亡形式。
添加共刺激信号(例如CD28)是值得注意的,因为该信号也已被掺入另一种称为嵌合抗原受体T细胞(CAR-T)治疗的免疫疗法中5,在该疗法中,一种受体被改造成能够识别癌症-细胞抗原,包括T细胞活化域,例如CD3和CD28。在三特异性抗体中包括CD28结合域的主要原因是T细胞共同刺激。但是,CD28也经常在多发性骨髓瘤细胞中表达,因此这可能会增加抗体对骨髓瘤细胞的亲和力,从而使其能够与CD38低,以前的daratumumab治疗掩盖或缺失的细胞结合。
为了证实CD28结合域增强了三特异性抗体的活性,作者制作了该抗体的版本,其中三个结合域的不同组合都发生了突变。他们在具有人类T细胞和人类骨髓瘤细胞的“人性化”模型小鼠中测试了这些版本。功能性的靶向CD28的结构域可增强T细胞活化,高于使用缺乏该结构域的抗体观察到的。这种增强的T细胞活化作用促使T细胞增殖以及T细胞中抗凋亡蛋白Bcl-xL的表达,支持了作者的假设,即具有共刺激信号将阻止T细胞凋亡。抗体上CD28靶向结构域的存在增强了T细胞在体外和人源化小鼠模型中杀死不同骨髓瘤细胞系的能力,即使在测试的最低抗体剂量下也是如此。
这项研究的主要局限性在于,如果高度刺激免疫系统,可能会发生称为细胞因子释放综合征(CRS)的副作用。在CRS中,许多T细胞的同时激活导致免疫系统细胞过度释放称为细胞因子的信号分子,从而引发炎症。 CRS可能与双特异性抗体和CAR-T一起发生。它通常表现为发烧,但在严重的情况下可能发展为致命的多器官衰竭6。
报告得出,通过静脉内注射对猴子给药时,三特异性抗体与细胞因子相关的毒性,但如果将其通过皮下(皮下)递送,毒性则较小,导致逐渐逐渐暴露于抗体。令人放心的是,在这些测试中,包含CD28靶向域不会导致压倒性的CRS。然而,一个关键的警告是,猴子中CD38的含量远低于多发性骨髓瘤患者,而且较高的CD38含量以及因此抗体介导的T细胞活化可能会增加人类CRS的风险。 。但是,就抗体对健康非癌细胞的可能负面影响而言,可以放心的是,在用CD38处理的猴子中,仅观察到表达CD38的正常白细胞(例如淋巴细胞和骨髓细胞)的数量短暂减少。抗体。该研究的另一个局限性在于,作者没有评估这种三特异性抗体形式是否可能引发针对该抗体的免疫反应并引起其快速破坏。
使用三特异性抗体靶向癌症是一项重要的概念性进展,它是基于该小组先前针对HIV的三特异性抗体所做的工作7。 对于多发性骨髓瘤,需要新的治疗方法,因为即使是最有效的新兴疗法,包括靶向BCMA抗原的CAR-T,也仅对大多数人有效[10-10]。 三特异性抗体是一种灵活的平台,可以提供一种在肿瘤微环境中特异性递送免疫调节信号(例如共刺激信号和检查点阻断剂)的精确组合的方法,这可能比全身给药更安全,更有效 单个,单特异性免疫调节抗体的组合。 这种使免疫疗法比目前更精确和有效的努力可能有必要扩大免疫疗法的范围,以包括迄今为止证明难以靶向的多种类型的癌症。

哺乳动物的免疫系统产生大量的抗体,抗体也可以被工程化以识别治疗靶标。抗体通常识别单个抗原,该抗原可能是引起疾病的成分或蛋白质或糖的异常形式。这类针对癌细胞靶标的单特异性抗体可以募集免疫细胞,包括嗜中性粒细胞,天然杀伤细胞和巨噬细胞,以杀死或摄入癌细胞。
也可以对抗体进行改造,以阻断或刺激与其结合的蛋白质的功能。例如,存在抑制T细胞功能的调节受体,而经过工程设计以阻断这些受体的抗体提供了称为检查点阻断的临床策略,可增强T细胞功能。这些抑制性受体控制着T细胞衰竭,T细胞衰竭是一种无功能的T细胞状态,可以防止自身免疫,并且可以在肿瘤微环境中发生,因为癌症逃避了T细胞介导的抗肿瘤反应。检查点阻断疗法可以唤醒疲惫的抗肿瘤T细胞,从而获得巨大的临床益处,但同时也可能引起自身免疫毒性。 Wu及其同事开发的抗体采用类似的方法来增强针对癌细胞的T细胞活性。然而,他们的方法刺激了能积极增强T细胞功能的受体的功能,而不是阻断抑制性受体的功能。
Wu等人开发的人抗体。 基于双特异性抗体技术,该技术可将两种不同抗体的抗原识别域重新配置为一个双特异性分子。 双特异性抗体通常将一种抗原靶向癌细胞表面,将一种抗原靶向T细胞上称为CD3的蛋白质复合物。 CD3是T细胞受体(TCR)复合物的一部分。 TCR还包括抗原识别结构域,并在抗原结合时向T细胞传递激活信号。 抗体与CD3的结合也会产生激活信号。 因此,这种双特异性抗体可以激活T细胞,使其与癌细胞紧密相连(与T细胞的天然抗原特异性无关),并将其杀伤能力重新导向癌细胞。
该概念已证明对靶向癌细胞上的CD3和CD19的双特异性抗体blinatumomab具有临床疗效。 Blinatumomab治疗可将晚期癌症B细胞急性淋巴细胞白血病(B-ALL)2的患者的缓解率和生存率提高一倍,并且正在作为B-ALL初始治疗的一部分进行测试,并有望在早期结果3。
Wu及其同事设计了一种聪明的策略,可同时促进T细胞活化并增强与多发性骨髓瘤有关的癌细胞的靶向性,多发性骨髓瘤是血液中浆细胞的癌症。作者开发了一种三特异性抗体,该抗体经工程改造,具有三个抗原结合位点,而不是两个。这种三特异性抗体靶向CD3以及蛋白质CD38(在癌细胞上)和CD28(在T细胞上)。靶向CD38的抗体daratumumab在临床上可有效治疗该疾病4,而CD38也是其他癌症(例如急性淋巴白血病和急性髓性白血病)的潜在靶标。
CD28属于一类蛋白,称为共刺激受体,可正向调节T细胞活化。当T细胞通过TCR识别其靶抗原时,共刺激受体(如CD28)需要额外参与才能实现有效免疫应答所需的持续T细胞增殖。在没有共同刺激的情况下,通过TCR激活会导致T细胞无反应状态(称为无反应状态)或相关的疲劳状态。在没有共同刺激的情况下,长时间激活TCR可能导致T细胞经历一种称为细胞凋亡的程序性细胞死亡形式。
添加共刺激信号(例如CD28)是值得注意的,因为该信号也已被掺入另一种称为嵌合抗原受体T细胞(CAR-T)治疗的免疫疗法中5,在该疗法中,一种受体被改造成能够识别癌症-细胞抗原,包括T细胞活化域,例如CD3和CD28。在三特异性抗体中包括CD28结合域的主要原因是T细胞共同刺激。但是,CD28也经常在多发性骨髓瘤细胞中表达,因此这可能会增加抗体对骨髓瘤细胞的亲和力,从而使其能够与CD38低,以前的daratumumab治疗掩盖或缺失的细胞结合。
为了证实CD28结合域增强了三特异性抗体的活性,作者制作了该抗体的版本,其中三个结合域的不同组合都发生了突变。他们在具有人类T细胞和人类骨髓瘤细胞的“人性化”模型小鼠中测试了这些版本。功能性的靶向CD28的结构域可增强T细胞活化,高于使用缺乏该结构域的抗体观察到的。这种增强的T细胞活化作用促使T细胞增殖以及T细胞中抗凋亡蛋白Bcl-xL的表达,支持了作者的假设,即具有共刺激信号将阻止T细胞凋亡。抗体上CD28靶向结构域的存在增强了T细胞在体外和人源化小鼠模型中杀死不同骨髓瘤细胞系的能力,即使在测试的最低抗体剂量下也是如此。
这项研究的主要局限性在于,如果高度刺激免疫系统,可能会发生称为细胞因子释放综合征(CRS)的副作用。在CRS中,许多T细胞的同时激活导致免疫系统细胞过度释放称为细胞因子的信号分子,从而引发炎症。 CRS可能与双特异性抗体和CAR-T一起发生。它通常表现为发烧,但在严重的情况下可能发展为致命的多器官衰竭6。
报告得出,通过静脉内注射对猴子给药时,三特异性抗体与细胞因子相关的毒性,但如果将其通过皮下(皮下)递送,毒性则较小,导致逐渐逐渐暴露于抗体。令人放心的是,在这些测试中,包含CD28靶向域不会导致压倒性的CRS。然而,一个关键的警告是,猴子中CD38的含量远低于多发性骨髓瘤患者,而且较高的CD38含量以及因此抗体介导的T细胞活化可能会增加人类CRS的风险。 。但是,就抗体对健康非癌细胞的可能负面影响而言,可以放心的是,在用CD38处理的猴子中,仅观察到表达CD38的正常白细胞(例如淋巴细胞和骨髓细胞)的数量短暂减少。抗体。该研究的另一个局限性在于,作者没有评估这种三特异性抗体形式是否可能引发针对该抗体的免疫反应并引起其快速破坏。
使用三特异性抗体靶向癌症是一项重要的概念性进展,它是基于该小组先前针对HIV的三特异性抗体所做的工作7。 对于多发性骨髓瘤,需要新的治疗方法,因为即使是最有效的新兴疗法,包括靶向BCMA抗原的CAR-T,也仅对大多数人有效[10-10]。 三特异性抗体是一种灵活的平台,可以提供一种在肿瘤微环境中特异性递送免疫调节信号(例如共刺激信号和检查点阻断剂)的精确组合的方法,这可能比全身给药更安全,更有效 单个,单特异性免疫调节抗体的组合。 这种使免疫疗法比目前更精确和有效的努力可能有必要扩大免疫疗法的范围,以包括迄今为止证明难以靶向的多种类型的癌症。




 购物车
购物车 



